电子化提交的特点和优势
医药行业电子提交目前主要由美国、欧洲、日本的监管机构驱动电子提交物流程的变革。以下列举了其特点和优势:
- 标准化的数据传输,保护隐私和安全
- 增加对提交过程的可见性
- 替换常规提交过程(纸质、CD等),减少纸张成本
- 缩短在提交过程中的交付/审批时间,简化申请过程
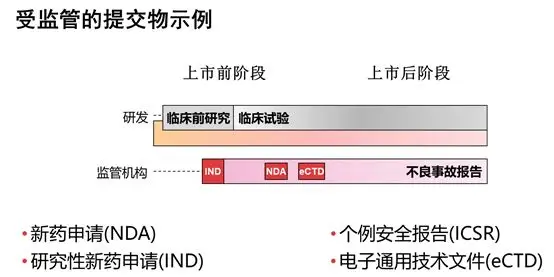
药品注册申请的技术文件编写中可采用统一的格式,即eCTD(电子通用技术文件),大大减少了企业财力和物力的投入,提高了注册的效率;对于监管机构来说,所有申报递交的文件格式,信息范围及结构的标准化将会更有利于资料的审阅,管理,传输以及归档。
客户对接案例1
美国食品和药物管理局(FDA)

FDA由美国国会即联邦政府授权,是专门从事食品与药品管理的最高执法机关,也是一个由医生、律师、微生物学家、化学家和统计学家等专业人士组成的致力于保护、促进和提高国民健康的政府卫生管制的监控机构。
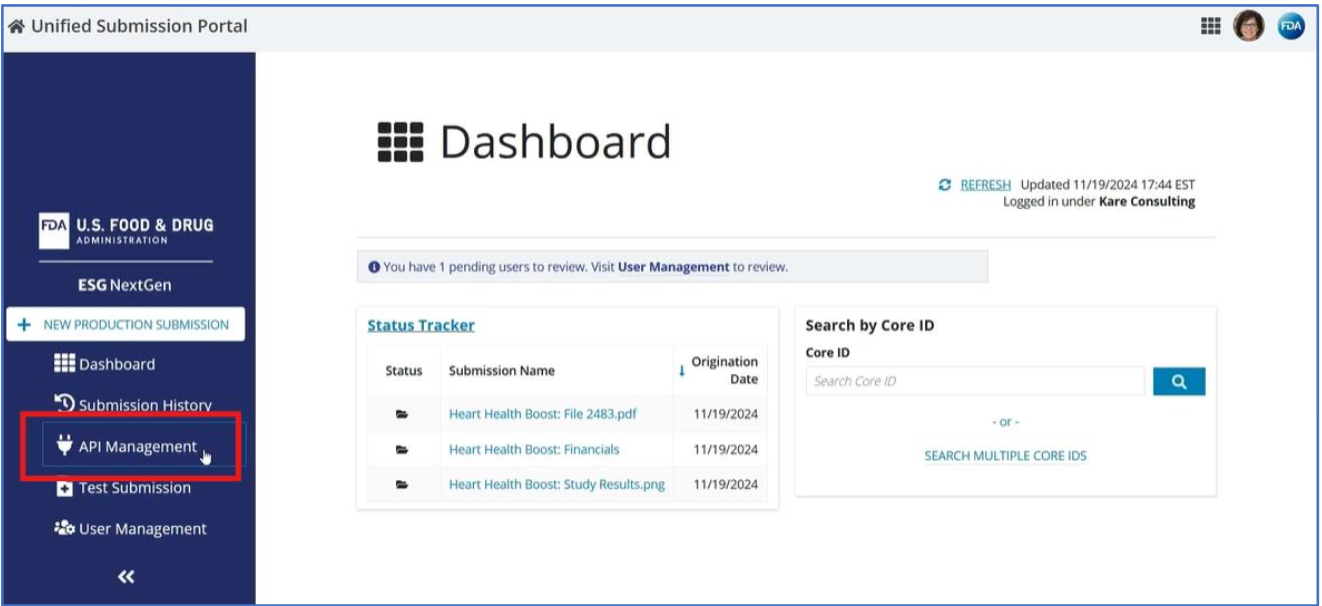
美国食品药品监督管理局 (FDA) 的 Electronic Submissions Gateway Next Generation (ESG NextGen) 是 FDA 的现代化平台,用于安全地接收和处理电子监管提交,其改进的架构支持大幅扩展提交带宽和存储。ESG NextGen 为 FDA 及其全球合作伙伴提供了一个高性能网关,允许无缝提交监管文件,并使 FDA 能够简化审查流程。ESG NextGen 作为一个统一的解决方案,作为向 FDA 安全提交、接收、确认、路由和通知所有监管提交的单一入口点。
- 统一提交门户 (USP):ESG NextGen USP 是一个用户友好的基于 Web 的平台,它取代了传统的 WebTrader 用户界面。USP 提供了向 FDA 提交监管信息并通过中心收据跟踪状态的功能。
- API 集成:ESG NextGen 的 API 套件支持以编程方式提交,使组织能够将提交流程直接集成到其内部系统中。此选项支持提交工作流程的自动化,并通过 Center 接收提交进行实时状态跟踪。
- AS2 协议 :用于 FDA 与其合作伙伴之间自动数据交换的系统到系统连接。
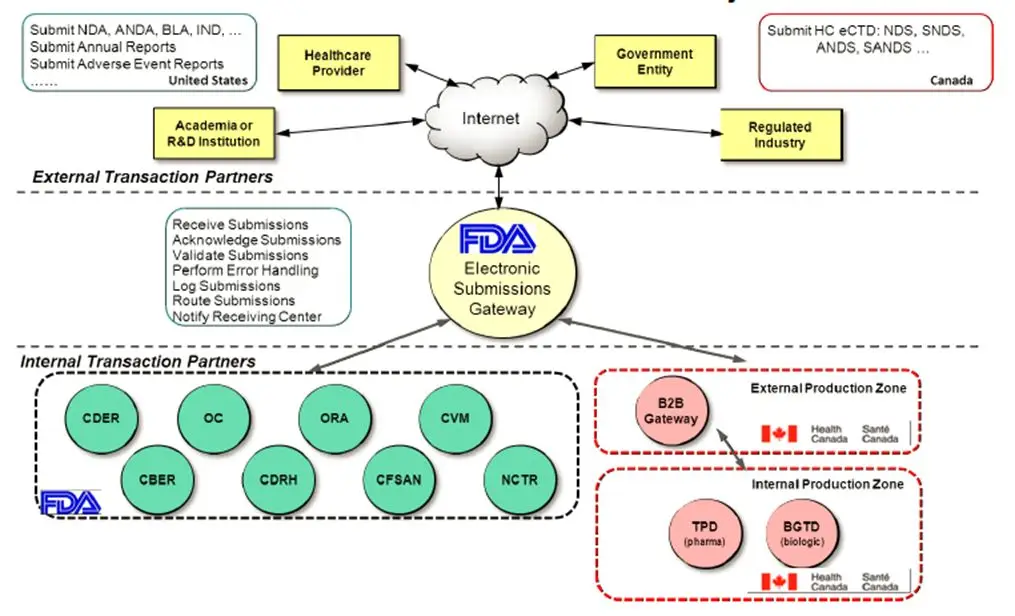
如下列举部分FDA电子提交网关所服务的内部机构:
- CBER (生物制品评价和研究中心)
- CDER (药品评价和研究中心)
- CDRH (设备仪器与放射健康中心)
- FAERS (FDA不良事件报告系统)
- CVM (兽药中心)
- OC (FDA专员办事处)
- CTP (烟草制品中心)
- CFSAN (食品安全与应用营养中心)
FDA电子提交网关现状:
- 8000多个企业和机构接入网关
- 平均1,000,000笔交易/月
- 支持大文件接收– 最大100GB
- 大部分通过医药行业AS2传输协议进行自动化提交
- 所有的电子提交物都通过这个集中的系统
- 新增API提交方式
客户提交案例2
欧洲药品管理局(EMA)

欧洲药品管理局(European Medicines Agency,EMA)成立于1995年,负责泛欧洲范围的药品审批。
政府需求:
- 制药公司向政府机构提供不良事件和临床试验报告等电子数据
- 从EMA路由传输到每个国家的健康管理机构
- 具有互操作性、消息级别的安全、基于内容的路由以及可靠的消息传递
- 支持实时传输跟踪、审计和存档
- 可以应对接入不断增长的机构数量
- 对接64个制造商安全系统
- 对接40个欧盟国家的健康主管机构
EUDRAVIGILANCE网关特点:
- 兼容EMA各种技术指标,无需写代码或选择其他解决方案。
- 提供灵活的认证管理架构,可使用自有认证系统,也可采用主流PKI证书体系。
- 合作伙伴配置参数的同步更新。
- 兼容医疗行业传输协议、报文格式,保证医疗行业合作伙伴之间的互联互通。
- 安全、高效的数据传输,整个传输过程可进行查询和监控。
客户对接案例3
日本厚生劳动省(MHLW/PMDA)

日本厚生劳动省是日本负责医疗卫生和社会保障的主要部门,提供药品和食品安全、社会保险和社会保障、劳动就业、弱势群体社会救助等职责。
日本厚生劳动省电子提交网关。
电子提交网关的主要特点:
- 实现eSubmissions功能性:支持临床数据eCTD/CDISC电子化提交
- 高可靠性:99.99% 24 x 7
- 系统支持:
- 130+企业接入能力
- 每家公司5-10个用户
- 每年总交易数<2,000
- 文件大小支持:3GB to 30GB
- 安全机制
- 身份验证、 加密、 回执 (可靠的消息传递)
- 通过DMZ Secure Relay实现双层防火墙保护机制,同时避免使用UDP带来的安全风险。
- 可扩展性和灵活性:可供扩展将来使用的其他类型的电子数据。
- 后端系统集成和格式校验集成,支持格式数据解析,并可直接写入数据库。